如何用好“双刃剑”——巯嘌呤的骨髓抑制风险
骨髓是人体内的造血组织,能产生白细胞、血小板和红细胞等。其中,白细胞负责免疫,血小板负责止血,而红细胞负责运氧(如下图)。
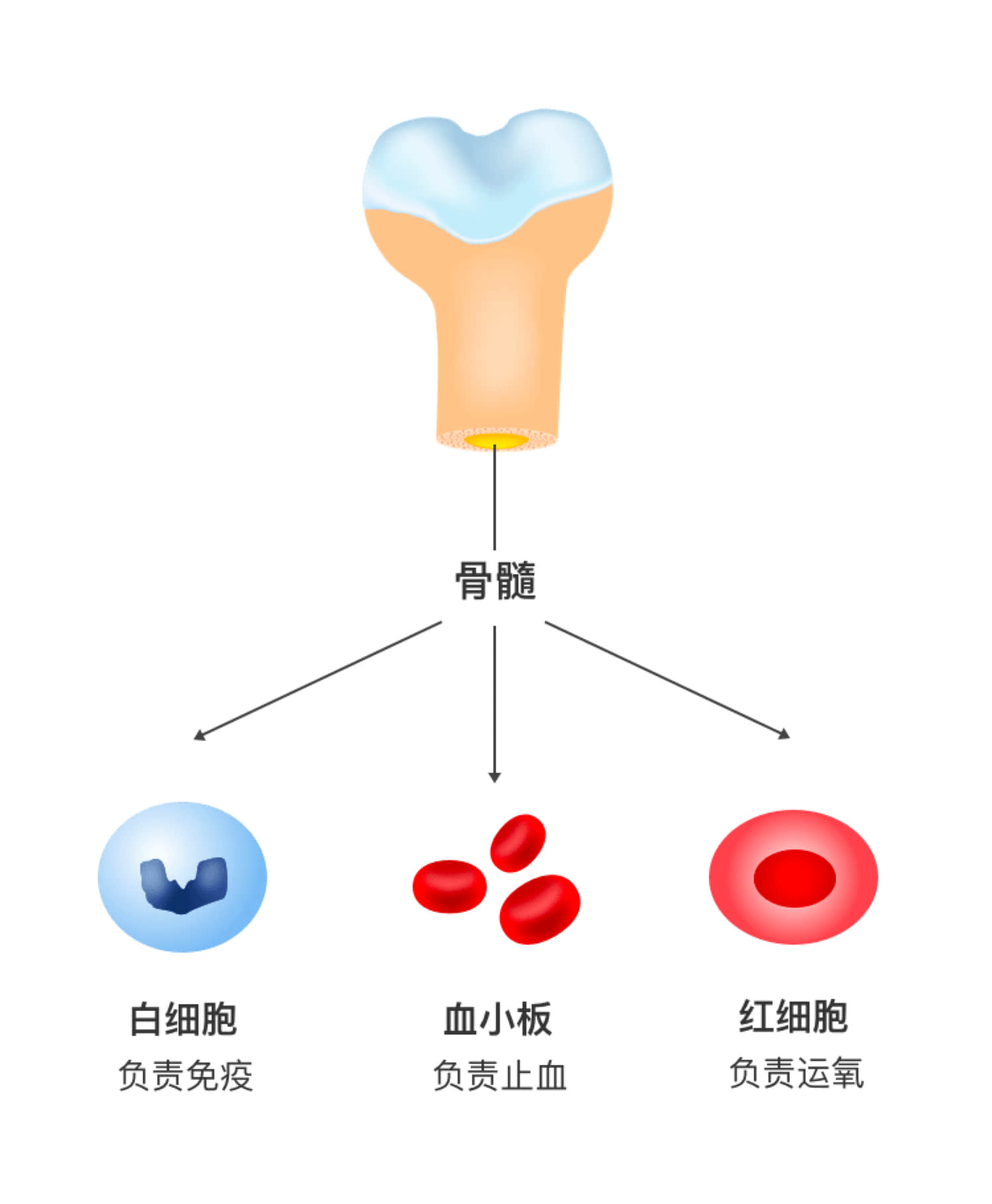 骨髓功能受到抑制,首当其冲的就是白细胞,白细胞减少,免疫下降,容易感染;其次是血小板,血小板减少,出血风险升高;而红细胞受骨髓抑制影响较小,下降通常不明显。
骨髓功能受到抑制,首当其冲的就是白细胞,白细胞减少,免疫下降,容易感染;其次是血小板,血小板减少,出血风险升高;而红细胞受骨髓抑制影响较小,下降通常不明显。
巯嘌呤类药物发生严重的骨髓抑制并不少见。此类药物包括巯嘌呤 (MP)和硫鸟嘌呤(TG),主要用于急性白血病和慢性白血病的急变期治疗;还包括硫唑嘌呤(AZA),主治非恶性免疫疾病如系统性红斑狼疮、炎症性肠病、类风湿关节炎等。在东亚炎症性肠病患者中,接受 AZA 治疗的骨髓抑制发生率为 20%~40%[1]。
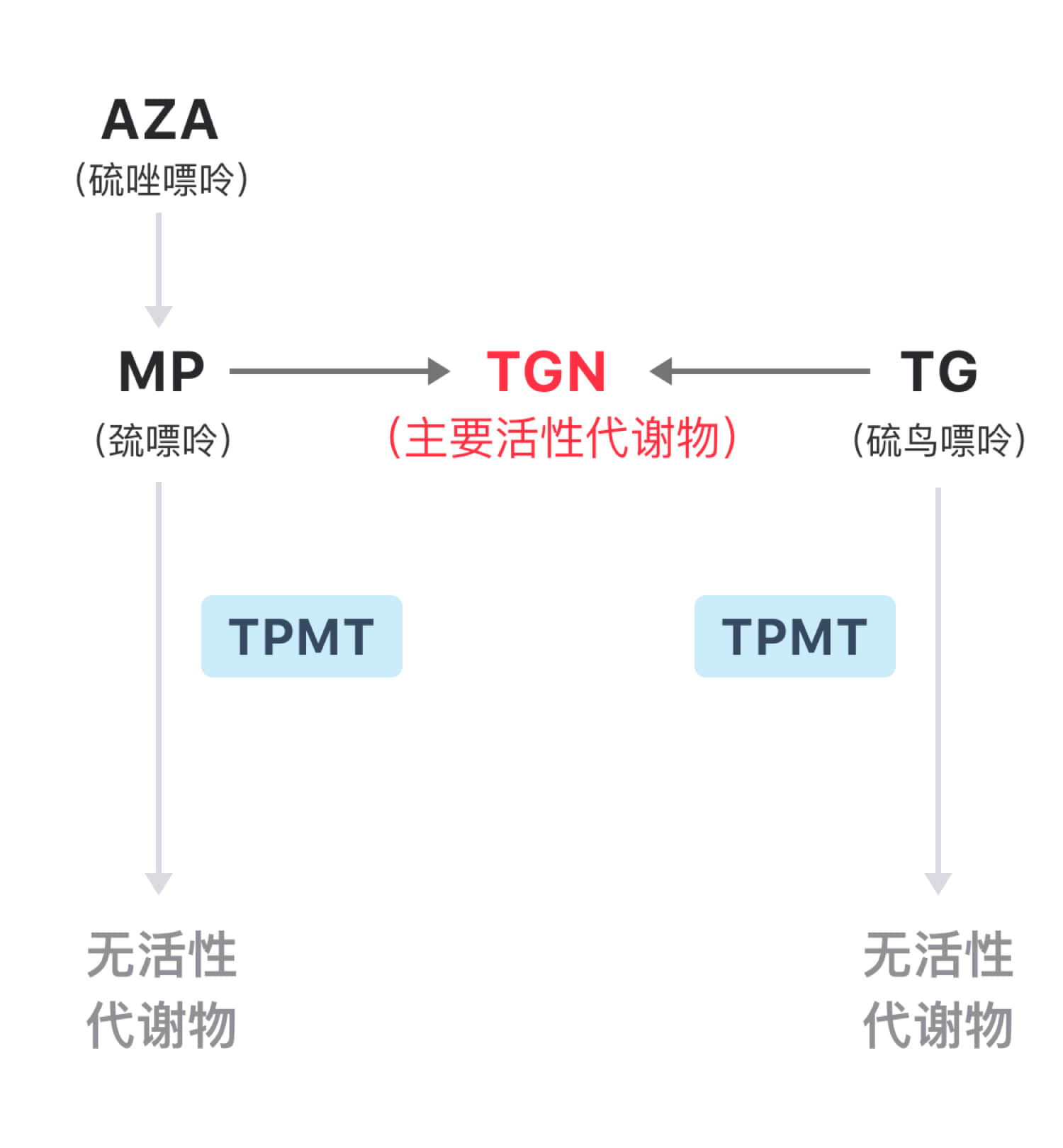
巯嘌呤类药物一部分在 TPMT 酶作用下代谢成无活性的代谢物,另一部分则被代谢为 TGN (如下图)。而 TGN 是巯嘌呤类药物的主要活性代谢物,TGN 水平升高,则骨髓抑制风险升高。
目前关于巯嘌呤类药物导致骨髓抑制的病例报告中,一部分是由于服用超过常规剂量的此类药物而引发骨髓抑制;然而,另外一部分患者即使服用常规剂量,也发生了骨髓抑制。
为什么会出现这一情况呢?
这是因为,这一部分患者的 TPMT 基因发生了变异。据统计,TPMT 基因在中国人群中总体变异率为 2.91%[2]。
当编码 TPMT 酶的基因发生变异,酶活性降低,药物清除减少,就会导致 TGN 水平升高,骨髓抑制风险升高。
编码 TPMT 酶的基因变异多态性导致了人与人之间代谢型的不同,主要分为 3 种代谢型:快代谢型、中间代谢型和慢代谢型[3]。其中,中间代谢型和慢代谢型的人使用常规剂量的巯嘌呤类药物即可引起药物体内蓄积,骨髓抑制风险升高。
参考文献:
1.曹倩.2018.硫唑嘌呤治疗炎症性肠病——大小剂量选择原则.中国实用内科杂志.38(3):184-186.
2.刘跃平,徐含青,杨翔,黄庆,府伟灵.2015.TPMT 基因型在中国人群中的分布.临床检验杂志. 33(9):711-714.
3.Relling MV, Gardner EE, Sandborn WJ, et al. 2011. Clinical Pharmacogenetics Implementation consortium Guidelines for Thiopurine Methyltransferase Genotype and Thiopurine Dosing. Clin Pharmacol Ther. 89 (3):387-391.